与在肿瘤组织和部分正常组织中同时表达的肿瘤相关抗原(TAA,Tumor-Associated Antigen)相比,肿瘤基因突变产生的肿瘤特异抗原(TSA,Tumor-Specific Antigen)不仅具有肿瘤组织特异性,也具有更高的免疫原性,因此靶向TSA无论是安全性还是疗效都要优于靶向TAA。然而,由于肿瘤的基因突变是随机发生的,因此大部分TSA是每个患者所特有的,只能进行个性化治疗。目前新生抗原疫苗就是通过预测肿瘤基因突变所产生的抗原,制备个性化肿瘤疫苗进行治疗。虽然该疗法在临床上观察到了一定的疗效,但总体疗效偏低。主要是由于目前新生抗原预测的准确率太低,大部分预测的抗原肽不能激发T细胞免疫反应,无法建立有效的抗肿瘤免疫反应。而按照传统的TCR-T细胞治疗开发流程,开发针对个性化TSA的TCR-T细胞药物同样不可行,因为从TCR筛选、验证、疗效与安全性评估、到临床应用,不仅需要经历长达5-10年的时间,还需要上亿的研发投入。
2022年2月14日,中山大学肿瘤防治中心周鹏辉、丁培荣、刘振江、张晓实、左志向及广东省实验动物监测所李文德课题组等在Cell Research 在线发表题为Defined tumor antigen-specific T cells potentiate personalized TCR-T cell therapy and prediction of immunotherapy response 的研究论文。该研究从鉴定和表征肿瘤中识别肿瘤新生抗原的T细胞出发,发现 CXCL13是肿瘤抗原特异T细胞(Tas,Tumor antigen-specific T cell)特有的分子标志物。进一步克隆这些Tas细胞的TCR,制备成TCR-T细胞,能够特异靶向患者的肿瘤抗原,并有效治疗患者来源的PDX肿瘤。该研究利用患者自身免疫系统所产生的攻击肿瘤的Tas细胞,首次建立了个性化TCR-T细胞疗法,能够同时靶向多个肿瘤抗原。广州泛恩生物对个体化TCR-T细胞的制备流程进行了全面优化,并完成了GMP生产工艺开发,能够在约6周的时间内为患者制备出个性化TCR-T细胞(图1)。该疗法目前已经在中山大学肿瘤防治中心开展IIT临床试验(NCT03891706),有望为大部分实体肿瘤患者提供疗效更好、安全性更高的个性化TCR-T细胞治疗。

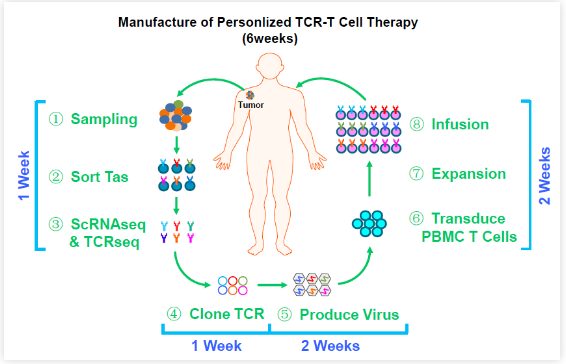
图1 个性化TCR-T细胞疗法流程图
该研究首先建立了一个体外肿瘤抗原刺激系统来验证单细胞测序所得TCRs的抗原特异性(图2)。简单来说,单细胞测序筛选到的TCR序列被构建到慢病毒载体中,随后感染外周血单核细胞(PBMCs)中的T细胞以建立TCR-T细胞。通过肿瘤和癌旁组织的全外显子组测序(WES)和RNAseq鉴定来自肿瘤突变的潜在新生抗原。并以EBV病毒感染自体B淋巴细胞转化为抗原提呈细胞(APCs)。体外肿瘤抗原刺激是通过将构建的TCR-T细胞与包含肿瘤特异性突变序列的串联微基因转导的APCs共培养来实现的。随后通过流式检测TCR-T细胞产生IFNγ的能力来评价TCR对肿瘤新抗原的应答。同时,还将测序患者的肿瘤移植到免疫缺陷NSG小鼠体内,建立患者源性异种移植(PDX)模型,用于TCR-T细胞治疗实验,评估其治疗效果。
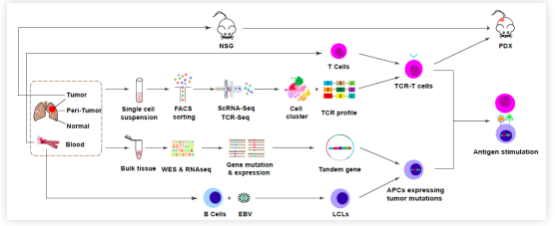
图2 体外肿瘤抗原刺激系统
研究收录了5例肺癌患者,通过单细胞 mRNA 测序 (scRNA-seq)、TCR 测序 (TCR-seq) 对肿瘤、癌旁、正常组织和外周血样本进行了全面表征,鉴定出了10个CD4和9个CD8细胞亚群。鉴于Tas细胞受到肿瘤抗原刺激后会发生TCR扩增以及基因表达的改变,形成与旁观者T细胞(Bystander T cell)不同的特征,作者详细分析了这些T细胞亚群以及其所携带的TCR在不同组织中的分布,以及与肿瘤突变负荷(TMB)的相关性,从中找到了在肿瘤中富集,所携带TCR在肿瘤组织中特异扩增,并与TMB正相关的亚群。体外抗原刺激证明这些亚群能够被肿瘤新生抗原特异激活,从而定义为Tas细胞亚群。随后对Tas细胞进行基因表达特征分析发现 CXCL13 是 CD4+ 和 CD8+ Tas 细胞的独特标记。并且瘤内 CXCL13的表达水平准确地预测了免疫检查点阻断剂的治疗反应,表明 Tas 细胞在抗肿瘤免疫中具有关键作用。重要的是,用 Tas 细胞TCR 制备的 TCR-T 细胞对自体患者来源的PDX肿瘤显示出显著的治疗效果。
该研究进一步发现 CD200 和 ENTPD1 可分别作为 CD4+ 和 CD8+ Tas 细胞的表面标志物,从而可以通过流式细胞分选仪 (FACS) 分选将 Tas 细胞从肿瘤中分离出来。体外刺激实验证明分选出的Tas细胞对自体肿瘤细胞具有较强的识别和杀伤作用。最后,该研究建立了一套基于Tas细胞的个性化TCR-T细胞疗法。
尽管细胞治疗在肿瘤的临床治疗,尤其在是在血液肿瘤治疗中,取得了成功的应用,但是细胞治疗的靶点仍十分有限,只适用于一小部分患者。并且,目前绝大部分CAR-T和TCR-T细胞治疗都是靶向TAA。这类抗原虽然在肿瘤组织中高表达,但同时也在部分正常组织中表达,如NY-ESO-1、GP100、MAGE等【1,2】。以TAA为靶点的细胞治疗在攻击肿瘤的同时,同样可能攻击正常组织,产生毒副作用。既往的CAR-T与TCR-T临床试验中就出现过因攻击正常组织而死亡的病例报道【3,4】,因此靶向TAA的T细胞治疗存在较大的安全性问题。
虽然靶向肿瘤突变抗原的TCR-T细胞治疗不仅安全性高,疗效也将更好,但是由于这些抗原由肿瘤中的随机突变产生,大部分为个别患者所特有的抗原,没有广谱性,无法提前开发好相应的TCR-T细胞。按传统的研制方法为一个患者所独有的个性化肿瘤抗原定制相应的TCR-T细胞需要很长的时间和大量的投入,难以实现。因此长期以来新生抗原无法作为TCR-T细胞治疗的靶点用于治疗,目前的TCR-T细胞治疗仍然以靶向在部分患者中共存的TAA 为主。
肿瘤新生抗原已经被应用于个性化肿瘤疫苗。即通过对肿瘤组织测序后,预测潜在的肿瘤抗原,快速合成预测的抗原肽,以疫苗的形式刺激患者免疫系统,扩增体内能够识别这些肿瘤抗原的T细胞,获得治疗效果。但目前个性化新生抗原疫苗在临床上的疗效较低。肿瘤中的基因突变所产生的抗原肽,必须经过蛋白酶体处理后,装载到HLA分子,再呈递到细胞表面,才能被免疫系统识别。同时在患者的T细胞中,存在识别这些抗原的TCR,才能够激发相应的免疫反应。因此不是肿瘤中所有的基因突变都能成为抗原,而只是其中一小部分。目前所采用的肿瘤抗原预测方法,主要通过计算突变的抗原肽与HLA分子的亲和力来进行预测,准确率太低,只有约20-30%的预测抗原能够在患者体内激发出相应的T细胞。另外,通过疫苗所刺激出来的T细胞数量同样有限,而能够进入肿瘤组织进行攻击的则更少。这些原因导致形成的抗肿瘤免疫反应不足,难以产生显著的疗效。
周鹏辉教授团队与合作者从抗肿瘤免疫反应的基础理论出发,即患者的肿瘤抗原能够激活患者自身的T细胞免疫反应,这些激活的Tas细胞随后进入并攻击肿瘤组织。因为Tas细胞在肿瘤组织中受到肿瘤抗原的刺激,必将产生与旁观者T细胞不同的基因表达变化与TCR扩增等特征。因此通过系统表征Tas细胞,将能够获得Tas细胞的分子标志物,从而快速鉴定Tas细胞,获得其TCR,从患者体内直接获取识别自身肿瘤抗原的TCR,体外制备大量的TCR-T细胞用于治疗。该疗法以Tas细胞的准确鉴定为基础,无需知道肿瘤抗原序列,成功避开了新生抗原疫苗的缺陷,实现了在短时间内为患者定制出个性化的TCR-T细胞。
有意思的是,Science在2022年2月25日同样发表了一篇表征Tas细胞的研究论文“Molecular signatures of antitumor neoantigen-reactive T cells from metastatic human cancers”,该工作来自于美国国家癌症研究所Steven Rosenberg博士实验室,采用了与本研究类似的方法,研究结果与本研究一致。但该Science论文只对Tas细胞进行了表征。而本研究则在表征Tas细胞后,以准确鉴定Tas细胞为基础,首次建立了个体化TCR-T细胞治疗,并在PDX模型中获得了有效验证。另外本研究还发现Tas细胞的分子标志物CXCL13可以准确预测免疫检查点抑制剂的疗效。因此本研究的发现对未来个体化精准免疫治疗具有重要的价值。
与靶向TAA的传统TCR-T细胞治疗相比,该疗法具有多个显著的优点:1)靶向肿瘤特异抗原,安全性更高;2)可采用多个TCR同时靶向多个肿瘤特异抗原,预期疗效更好;3)TCR来源于患者自身,无HLA限制性;4)靶向患者自身的肿瘤抗原,不受已知抗原的限制,适用于大部分实体肿瘤患者。
中山大学肿瘤防治中心何晶晶、熊昕昕、杨寒、李丹丹、刘雪飞为本文的共同第一作者。中山大学肿瘤防治中心周鹏辉教授、丁培荣教授、刘振江博士、张晓实教授、左志向教授及广东省实验动物监测所李文德教授为本文的共同通讯作者。
*本文转自BIOART
