近期,Bio会客厅很荣幸采访到第八届百奥赛图模式动物与医药产业大会报告嘉宾周鹏辉教授,就肿瘤免疫治疗进行深入、全面的探讨,并以其研究组近期在个性化TCR-T细胞治疗方向上的突破作为重点展开介绍。
嘉宾介绍

周鹏辉 教授
广州泛恩生物创始人,中山大学肿瘤防治中心,华南肿瘤学国家重点实验室教授、博士生导师。2008年毕业于美国密西根大学(University of Michigan),获免疫学博士,在哈佛大学医学院 (Harvard Medical School)完成博士后研究,2014年入选中山大学“百人计划”青年杰出人才,2015年入选“海外高层次人才计划”,2017年入选广东省“珠江人才计划”领军人才。
长期从事肿瘤免疫学与肿瘤免疫治疗转化研究。通过高通量研究免疫系统和肿瘤之间的相互作用,阐明肿瘤细胞抵抗免疫攻击的逃逸机制,从中发现新的治疗靶标,并鉴定肿瘤特异的免疫细胞,尤其是识别肿瘤抗原的T细胞,建立高效的肿瘤免疫治疗新方法。研究成果发表于Nature、Cell、Cell Research、PNAS、Clinical Cancer Research、Cancer Immunology Research等重要学术期刊,其中部分研究结果已经转化到临床。所建立的个性化TCR-T细胞治疗特异识别患者特有的肿瘤新抗原,摆脱了对已知靶抗原的依赖,将细胞治疗的应用范围扩展到了大部分实体肿瘤患者,目前已经开始了I期临床试验。
采访内容
Q
周老师,您在肿瘤免疫治疗方向深耕多年,可否先为我们介绍一下目前的肿瘤免疫治疗有哪几类?
A
对肿瘤免疫治疗分类,最直观的方法便是按照免疫反应的进程来分类。免疫反应的第一步是抗原刺激,于是肿瘤抗原就可以用来制备肿瘤治疗性疫苗,从上游激活抗肿瘤免疫反应。肿瘤抗原包括一些已知的经典抗原,如GP100、NY-ESO-1、p53、GD2等,也包括特异性更好的由肿瘤基因突变产生的肿瘤新抗原。目前,肿瘤新抗原疫苗是研发热点,也是投资机构比较关注的方向。然而,疫苗依靠其所激活的免疫细胞,主要是T细胞来发挥疗效。虽然对晚期肿瘤患者会有一定的疗效,但由于疫苗所激活的T细胞数量有限,且这些免疫细胞进入肿瘤组织后,会受到肿瘤微环境的抑制,导致单用的效果不高,需要开展联合治疗。
提高肿瘤抗原呈递的效率,也是增强抗肿瘤免疫反应的关键步骤。一些靶向药物,如STING激动剂等,可促进抗原呈递细胞成熟和活化,提高肿瘤抗原呈递效率。其意义在于增强T细胞活化并使其能够迁移至肿瘤组织进行杀伤。
此外,人们还可直接在体外大量制备能够激活抗肿瘤免疫反应或者直接识别和攻击肿瘤的免疫细胞(如T细胞),回输患者,达到治疗的目的。细胞治疗分为很多种。一种是工程化的CAR-T和TCR-T治疗,这里的CAR和TCR都特异性地识别一个肿瘤抗原,并对表达这种抗原的肿瘤细胞进行攻击。例如识别CD19的CAR和识别NY-ESO-1的TCR。另一种是直接从患者体内获得识别肿瘤的T细胞,通常能够靶向多个不同的肿瘤抗原如TILs(Tumor Infiltrating Lymphocytes,肿瘤浸润淋巴细胞)治疗。受肿瘤微环境的抑制,这些T细胞在患者体内数量少,功能差。但在体外扩大培养的过程中可人为解除抑制、恢复其功能。这些具有足够数量和活性的T细胞回输给患者后,可实现对肿瘤的有力攻击。TILs治疗是一个非常成功的疗法,目前美国的Iovance公司已经完成了III期临床,总体效果良好。还有一些其他类型的细胞治疗如CAR-NK和CAR-M等,基本原理都是在细胞上装上一个肿瘤特异性靶向后,让细胞直接或协助攻击。例如巨噬细胞进入肿瘤后,可以协助吞噬抗原并促进抗原呈递。
免疫细胞在体内的活性受一系列信号通路的调节,例如抗原信号、共刺激信号、细胞因子和免疫检查点等。事实上,免疫检查点药物是目前临床上应用最为广泛的免疫治疗药物,可分为两大类:1)共抑制受体的阻断抗体,例如PD-1、CTLA-4等;2)共刺激受体的激动性抗体,例如4-1BB,GITR等。通过细胞因子促进抗肿瘤免疫反应,也是免疫治疗常见的方法,如IL-2,IL-15等细胞因子治疗。
现有的免疫治疗大概可以分为以上这些类型。将传统治疗(如放疗,化疗,靶向治疗等)与免疫治疗进行联合,改善肿瘤微环境,提高免疫治疗效果,也是目前在临床中广泛探索的方向。
Q
既然有这么多种免疫治疗方案,那么病人该如何选择呢?
A
患者可以通过检测一些与抗肿瘤免疫反应相关的指标来评估自己是否能从免疫治疗中获益。比如PD-(L)1抗体治疗与PD-L1的表达以及TMB(tumor mutational burden,肿瘤突变负荷)的高低相关,所以这些指标可用来预测患者是否能够从中获益。但由于抗肿瘤免疫反应是一个多步骤,多种免疫细胞参与的复杂过程,单个指标只能评估抗肿瘤免疫反应的某个环节,难以准确预测最终结果。我们在疗效预测方面开展了一部分研究工作,并找到了CXCL13等显著优于PD-L1和TMB的指标。目前我们正在通过优化多个指标的组合来全面评估抗肿瘤免疫反应,实现对免疫检查点阻断、TIL等免疫治疗效果的准确预测。
另一方面,免疫检查点治疗也伴随一定的风险,这主要来自于不可控的免疫反应。在正常人体内,免疫检查点对免疫反应的抑制是防止免疫系统攻击自身的重要机制,阻断后容易发生各种自身免疫疾病,如皮疹,肠炎,肝炎,甲减等,严重的会出现致死率高的急性心肌炎。如何预测副作用的发生并提前预防、及时处理,是目前临床亟待解决的难题。我们发现在血液中攻击自身抗原的T细胞含量和状态与免疫副反应的发生密切相关。在免疫治疗过程中跟踪检测此类T细胞的变化,能够提前预警免疫副反应的发生,为提前预防和干预免疫副反应的发生提供了有力的支持。
对于其他的免疫治疗如新抗原疫苗,则需要先检测患者的肿瘤中是否存在新抗原。TILs治疗主要依赖于患者肿瘤组织中识别肿瘤抗原的T细胞,因此可以通过检测肿瘤抗原特异性T细胞的含量来预测TILs在体外能否被成功培养,进而评估患者从此疗法中获益的潜力。目前TILs主要应用于晚期肿瘤,但晚期肿瘤获取组织比较困难,培养成功率也更低。未来可前移到早期患者。对于CAR-T和TCR-T细胞治疗,都需要检测肿瘤中有没有相关靶点的表达。总的来说,每种免疫治疗的方法都有一定检测手段来帮助患者选择。此外,这些免疫治疗方法与合适的传统治疗方案联用常常能够产生更好的疗效。
随着免疫治疗的快速发展,患者有了更多的免疫治疗方案可选择。但目前很多疗法尚处于临床试验阶段,还没有获批。这就需要患者或患者家属学习一些免疫治疗的相关知识,从中选择适合自己的治疗方案,加入临床试验。这些正在临床试验中的药物,如果临床试验成功,大概会在5-6年后上市,到那时会有更多关于这些产品的知识和广泛的推广,对于大部分患者来说就比较容易理解并接受治疗了。总之,治疗方案会越来越多,很多患者也不一定只接受一种治疗,只要是适合自己的免疫治疗都可以去了解,在医生的指导下进行选择和治疗。
Q
现在的免疫治疗能让多少患者从中获益?
A
现在像PD-(L)1这样的免疫检查点治疗的有效率大概在20%-30%,所以还有70%-80%的患者不能从中获益。虽然通过联合治疗能够进一步提高疗效,延长生存期,但还是会有一大部分患者不能获益。未来,随着CAR-T、TCR-T、TILs以及新抗原疫苗等疗法的应用,预计将近一半的患者可以从免疫治疗中获益。想要进一步扩大获益患者的比率,则需要开发全新的治疗方案。
我们研制个体化TCR-T的一个主要目的就是扩大细胞治疗的应用范围。现有的CAR-T和TCR-T通常是靶向一个已知肿瘤抗原,以肿瘤相关抗原为主,即在肿瘤中高表达,同时也在正常组织表达的非突变抗原。这类抗原数量有限,导致只有一小部分患者适合细胞治疗,并且还容易攻击正常组织。最好的肿瘤抗原是肿瘤基因突变产生的新抗原,即是肿瘤组织特异的,不会导致攻击正常组织,而且这类抗原的免疫原性强,治疗效果更好。但是,由于突变是在基因组上随机产生的,所以这类抗原是每个人所特有的。我们通过建立个性化TCR-T细胞治疗来靶向这些个性化的新抗原,希望以此来治疗那些没有现成靶点的患者,从而让约80%的患者能够从细胞免疫治疗中获益。
Q
看到您最近在Cell Research上发表了关于建立个性化TCR-T治疗的文章,您能为我们讲解一下整个疗法的全流程吗?
A
首先是通过穿刺、手术等方式获取肿瘤组织,处理成单细胞悬液后,根据我们前期建立的分子标志物,包括我们发现的非常特异的肿瘤抗原特异T细胞分子标志物CXCL13,还有其他细胞表面的标志物,来分选出识别肿瘤抗原的T细胞。随后,对这些T细胞进行单细胞测序获得TCR序列(同时测出TCR的α和β链),再根据代表T细胞功能的基因的表达来选择合适的TCR。获取TCR后,我们采用快速克隆技术构建到慢病毒载体,再用慢病毒去感染患者外周血来源的自体T细胞,制备TCR-T细胞,经过体外大量扩增后即可回输治疗。这个流程最快6周就可以完成,我们目前通常会控制在8周左右。我们正在优化的新工艺可以做到4周完成。
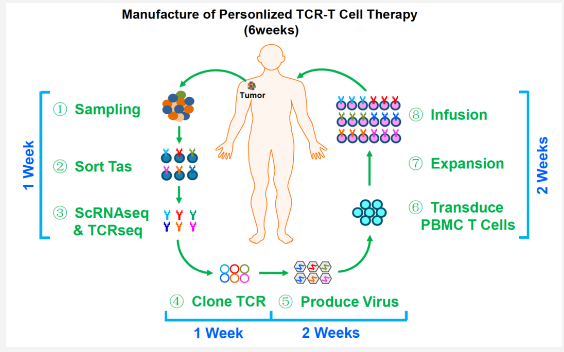
图1. 个体化TCR-T制备全流程[2]
Q
您使用了哪些分子标志物来去鉴别肿瘤特异性T细胞?
A
我们所鉴定的CXCL13是目前最好的指标,是唯一一个能够同时鉴定CD4和CD8肿瘤抗原特异T细胞的指标。CXCL13的一个重要功能是招募CXCR5+免疫细胞进入肿瘤,比如B细胞、巨噬细胞、抗原呈递细胞和T细胞自己。还有另外一些指标,虽然单个指标的准确性不高,但几个指标组合在一起使用时准确性较高。比如CD4和CD200可以把肿瘤抗原特异性CD4+ T细胞鉴定出来,CD8和ENTPD1可以覆盖大部分杀伤肿瘤的T细胞。但它们都不如CXCL13准确。另外,CXCL13是泛肿瘤的marker,在各种肿瘤亚型中的准确性都是最高的。
Q
您如何对找到的针对新抗原的TCR进行排序?对于一个病人,一般会使用多少个TCR呢,如何调配比例?
A
我们主要是结合两方面的信息进行选择。1)携带这些TCR的T细胞表达较好的激活,功能,增殖等基因,表明它是对肿瘤攻击能力较强的一个TCR。2)TCR的频率。我们发现频率越高的TCR所识别的抗原在肿瘤组织中的表达越广谱。虽然我们希望一个TCR所攻击的抗原在所有的肿瘤细胞上都表达,但通常很难做到100%。因此我们采用多个TCR进行治疗,每一个TCR可以靶向大部分肿瘤细胞,多个不同的TCR就能够实现对绝大部分肿瘤细胞的特异攻击。我们最高对一个病人使用过20个TCR,但这个数量带来的成本也会比较高。我们现在正在优化多少个TCR是最合适的。对于不同TCR之间的比例,我们有一套计算方法进行配比,达到均衡。
Q
这些TCR-T细胞进入病人体内后大概能存活多长时间,是否需要多次回输?
A
TCR-T细胞进入人体后开始扩增,一般会在一周以后达到高峰。根据过去已经发表的TCR-T的数据,TCR-T在患者体内最长的已经跟踪了十几年,一直存在。我们个体化TCR的优势是,这个TCR是患者自己产生的,它的安全性比较好。另外,我们开发了一套模拟体内T细胞分化的培养体系,在体外培养出具有高分化潜力的记忆T细胞。与目前大家采用常规方法所培养出来的记忆细胞有很大的不同,我们的T细胞在体内分化成效应细胞的潜力大幅提高。目前我们采用两次回输,也可以回输多次。需要注意的是,实体肿瘤治疗对T细胞的数量要求也是比较高的。
Q
与其他个性化TCR-T细胞治疗相比,您的技术方案有什么特点?
A
目前国内外有几家公司先预测和鉴定肿瘤新抗原,再用新抗原肽与MHC分子组成的四聚体去钓取识别该复合物的T细胞,接下来克隆这些T细胞所携带的TCR,经过抗原特异性验证后,用于制备TCR-T细胞进行治疗。理论上该方案可以筛选到识别新抗原的TCR,但是钓取TCR的过程成本高、耗时长,并且钓取出来后还要验证(因为这种方法钓取到的TCR会有很多假阳性,必须通过验证确定抗原特异性才能用于治疗),难以满足患者的需求。另外,只有一小部分突变能够成为抗原,而目前新抗原预测的准确率只有20-30%,进一步增加了TCR筛选的难度。
相比之下,我们通过分子标志物来准确获取患者身体里识别肿瘤新抗原的TCR;前期大量的实验已经证明了这些TCR全都特异识别患者肿瘤中的新生抗原,因此在应用时可直接使用,不需要知道这些TCR具体识别哪个肿瘤抗原;是一个直接且快速的方案,大大缩短了制备的时间。这也就是我们为什么能够在6周内完成细胞制备,最快可以做到4周内完成制备的原因。而及时治疗对肿瘤患者,尤其是晚期患者是非常关键的。我们很早就开始了该治疗方案的设计和研发,考虑到临床试验的开展,并没有马上投稿发表,直到最近才发表在Cell Research。
Q
除了个体化TCR-T,您有没有考虑过去做一些靶向已知抗原的TCR-T?
A
有的。除了个体化TCR-T细胞,我们选择了一部分安全性较高的已知肿瘤抗原开发了TCR-T细胞,例如靶向NY-ESO-1, HPV E6, HPV E7, KRAS等的TCR-T细胞。以及靶向EGFRVIII, EPH2A, GD2等CAR-T细胞。我们对这类TCR-T与CAR-T细胞进行了系统的改造,全面提高了抵抗实体肿瘤抑制微环境的能力,显著提高了对实体肿瘤的治疗效果。
Q
TCR-T细胞疗法需要和PD-1这种免疫检查点抑制剂联用吗?
A
需要的。实体肿瘤微环境强烈压制抗肿瘤免疫反应,因此回输到患者体内的TCR-T细胞在进入实体肿瘤后将要面临各种免疫抑制,最终失去功能。PD-(L)1等信号是压制TCR-T细胞的重要机制,因此与免疫检查点抑制剂联用能够减缓T细胞耗竭,维持更长的杀伤功能,获得更好的疗效。未来细胞治疗与免疫检查点抑制剂联用应该会是一个非常常见的治疗手段。此外还可以对T细胞进行改造,使其抵抗肿瘤微环境抑制。细胞治疗和放疗、化疗等联用也会很常见。通过传统治疗减小肿瘤,减少免疫细胞的工作量,让T细胞更高效地清理干净残余的瘤灶,提高治愈率。一些传统的治疗还能够促进抗肿瘤免疫反应。
Q
您能否介绍一下泛恩生物的业务和未来发展方向?
A
细胞治疗是我们的核心业务[3]。除了个体化TCR-T细胞治疗和针对已知靶点的TCR-T与CAR-T细胞治疗外,我们还开发了改进型的TILs治疗。目前TILs治疗最大的问题在于体外细胞培养的成功率较低,并且培养后的细胞质量不高。我们在这方面花了大量的精力,建立起了一整套模拟体内T细胞增殖与分化的培养体系,并通过富集肿瘤抗原特异T细胞,培养出高质量的TILs细胞,在提高培养成功率的同时,治疗效果也显著优于传统的TILs治疗。同时,我们已经建立了高效的体内递送技术,让对细胞的基因编辑在体内进行,将大幅降低TCR-T与CAR-T等细胞治疗的成本。
此外,我们也开发了一些免疫诊断产品,准确预测免疫检查点,TILs等的疗效,帮助我们挑选出适合于这些治疗的患者。目前国内外的细胞治疗逐步采用按疗效收费,非常需要精准的诊断方式来挑选有效的病人,这对于实体瘤来说尤为重要,因为实体瘤比血液瘤的治疗效率更低。我们的诊断产品主要以免疫组化,ELISA,流式分析等技术方案为主。不仅简单易行,费用也显著低于TMB等NGS(next generation sequencing)诊断方案。我们的目标是为大部分肿瘤患者提供精准、高效、价廉的免疫治疗。
Q
免疫诊断行业是不是竞争非常激烈?
A
随着肿瘤免疫治疗的广泛应用,临床迫切需要开展精准免疫治疗。因此免疫诊断产品同样是未来的重要发展方向,包括疗效预测,毒副作用预测,耐药检测等。目前免疫诊断还处于刚刚起步的阶段,参与的公司不多,总体竞争还不太激烈。但以NGS为基础的TMB检测由于门槛较低,竞争比较激烈。好的免疫诊断产品同样需要有扎实的研究基础,通过发现好的标志物来获得竞争优势。免疫诊断领域的未来值得期待。
周老师的研究正向着扩大受众人群、精准患者定位和快速低成本的方向推进,积极拓展着免疫治疗的边界。期待后续周老师开发的细胞治疗产品在临床上有很好的应用。
参考资料
1. https://www.grandviewresearch.com/industry-analysis/cell-therapy-market
2. He, J., Xiong, X., Yang, H. et al. Defined tumor antigen-specific T cells potentiate personalized TCR-T cell therapy and prediction of immunotherapy response. Cell Res (2022). https://doi.org/10.1038/s41422-022-00627-9.
3. 广州泛恩生物科技有限公司官网:http://www.fineimmu.com/
*本文转自BIO会客厅
